La classification périodique des éléments
1 La structure du nuage d'électrons
1.1 Les couches électroniques
- Les électrons d'un atome sont répartis sur différentes couches électroniques, appelées aussi niveaux d'énergie.
- A chaque couche on associe un entier positif appelé nombre quantique
1.2 Le remplissage de ces couches
Par convention on note les couches par des majuscules, et à la 1ère couche on associe la lettre K, L à la deuxième et ainsi de suite…
Selon le Principe de Pauli une couche de nombre quantique k ne peut contenir au plus que 2k2 électrons. Une fois que ce total est atteint, on dit que la couche est saturée.
On a donc comme niveau de saturation :
- K -> 2
- L -> 8
- M -> 18
Les couches se remplissent par ordre croissant, une fois qu'une couche est saturée, les électrons se placent sur la couche suivante. La couche K est la plus proche du noyau. ( faux à partir de la troisième couche ).
La dernière couche où se trouvent des électrons est appelée couche externe (ou couche de valence).
Exemple: dans le cas de l'atome d'hydrogène, Z=1, il n'a donc qu'un seul électron. Il se place sur K, et K est donc la couche externe.
1.3 Comment représenter la structure électronique ?
Il existe deux méthodes :
- On écrit la formule électronique de l'atome ou de l'ion : entre () le nom de la couche occupée et
en exposant le nombre d'électrons sur cette couche.
- Ex: (K)2 (L)8 (M)4
- On note dans des cases (contenant au maximum 2 électrons), et chaque couche de niveau
quantique k ne comportant que k2 cases, le nombre d'électrons présents.
- NB: à notre avis la première méthode est plus rapide.
1.4 La représentation de Lewis
- En Chimie ne sont intéressants pour nous que les électrons se trouvant sur la couche externe car ce sont eux qui déterminent les propriétés chimiques des atomes et des ions.
- La représentation de Lewis ne s'attache qu'aux électrons de la couche externe.
- Le noyau et les couches "internes" sont simplement représentées par le symbole de l'élément.
- Les électrons de la couche externe sont représentés par
- Un point si ils sont "célibataires"
- Un tiret si ils forment un doublet
- La valence d'un atome ou d'un ion est égale au nombre d'électrons célibataires sur sa couche externe.
Exemple: l'atome d'aluminium, Z=13, sa formule électronique est donc
(K)2 (L)8 (M)3. Il possède donc 3 électrons
libres sur sa couche externe, sa représentation de Lewis est donc
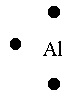
Si c'est un ion, on note sa charge en haut à droite de cette représentation
2 La classification périodique
Dans ce tableau, les éléments sont classés par nombre atomique Z croissant.
Signification des colonnes et des lignes :
2.1 Les familles
Tous les éléments d'une même colonne appartiennent à la même famille.
- La première colonne du tableau regroupe les alcalins
- L'avant-dernière les halogènes
- La dernière les gaz nobles
Tous les éléments d'une même famille ont le même nombre d'électrons sur leur couche externe
- Colonne 1 -> 1 électron sur la couche externe
- Col 2 -> 2
- Col 13 -> 3
- Col 14 -> 4
- Col 15 -> 5
- Col 16 -> 6
- Col 17 -> 7
- Col 18 -> 8
Ces éléments ont aussi une représentation de Lewis commune.
2.2 Périodes
Tous les éléments d'une même ligne appartiennent à la même période
Le numéro de la période indique le nombre de couches électroniques de l'atome
Si l'élément est sur :
- La 1ère ligne du tableau, seule la couche K est occupée (pas forcément saturée)
- La 2nde ligne du tableau, les couches K et L sont occupées
- Et ainsi de suite…
3 La règle de l'octet
Tous les gaz nobles (sauf l'hélium) possèdent 8 électrons sur leur couche externe, cette structure particulière est appelée structure en octet.
Cette structure est particulièrement stable et c'est pourquoi au cours des réactions chimiques, les atomes des éléments des autres familles tendent à acquérir cette structure.
Ce fait s'appelle La Règle de l'octet: Au cours des réactions chimiques les atomes cherchent à acquérir la structure du gaz noble le plus proche.
Exemples : les Alcalins : lorsqu'ils cèdent l'unique électron de leur couche externe
- ils deviennent des ions chargés positivement : des cations
- ils acquièrent une structure en octet sur leur "nouvelle" couche externe
- ils ont alors la même structure que le gaz noble qui les précède (en numéro Z dans le tableau)
A l'inverse, les halogènes vont gagner un électron et devenir des anions pour avoir la structure en octet du gaz noble qui les suit dans le tableau de la classification périodique.